原創(chuàng)不易,若轉(zhuǎn)載此文章,請聯(lián)系工作人員并在轉(zhuǎn)載文章中備注信息來源,否則按侵權(quán)處理!
有機光化學反應過程涉及到光的吸收、激發(fā)以及化學反應,是化學與物理學交叉的研究。與熱反應不同,它是一個激發(fā)態(tài)的反應。分子激發(fā)態(tài)是一個復雜的混合態(tài),想要了解有機光化學反應的原理,需要先了解分子吸收光子之后的激發(fā)態(tài)性質(zhì)。
激發(fā)態(tài)分子生成原理
分子的激發(fā)類型分為轉(zhuǎn)動激發(fā)、振動激發(fā)和電子激發(fā)。
分子吸收光變成激發(fā)態(tài)屬于電子激發(fā)過程。
根據(jù)分子軌道理論,原子通過共價鍵結(jié)合成分子時會形成成鍵軌道(σ、π)、反鍵軌道(σ*、π*)以及非鍵軌道(n)。基態(tài)有機物分子中的電子優(yōu)先占據(jù)能量較低的成鍵軌道以及非鍵軌道,反鍵軌道為沒有電子的空軌道。
σ軌道對應單鍵,軌道以頭碰頭方式連接,重疊度大,因而軌道能量越低,單鍵鍵能越強;
π軌道對應雙鍵或者三鍵,主要以肩并肩方式連接,軌道有一定重疊,軌道能量次低;
n軌道對應N、S、O等雜原子中的孤對電子,因為沒有成鍵,所以軌道能量與原子軌道能量一致,基本不變。
如圖1所示,當基態(tài)有機物分子吸收光之后,成鍵軌道和非鍵軌道中的電子都有可能被激發(fā)到反鍵軌道中變成激發(fā)態(tài)分子,絕大多數(shù)有機光反應都是通過n→π*以及π→π*躍遷進行的,此時相應的吸收波長分別在可見光區(qū)和紫外光區(qū)。
對于金屬有機絡合光催化劑如聯(lián)吡啶銥而言,根據(jù)晶體場理論金屬Ir3+在配體的八面體場作用下,其5個d軌道分裂成3個能量較低的t2g軌道和兩個能量較高的eg軌道,Ir3+的六個d層電子優(yōu)先填滿t2g軌道,eg為空軌道。由于配體的π*反鍵軌道能量位于t2g軌道和eg軌道之間,其分子吸收光子之后,t2g軌道的電子躍遷到配體的π*反鍵軌道上,實現(xiàn)M→L的電子躍遷[1]。
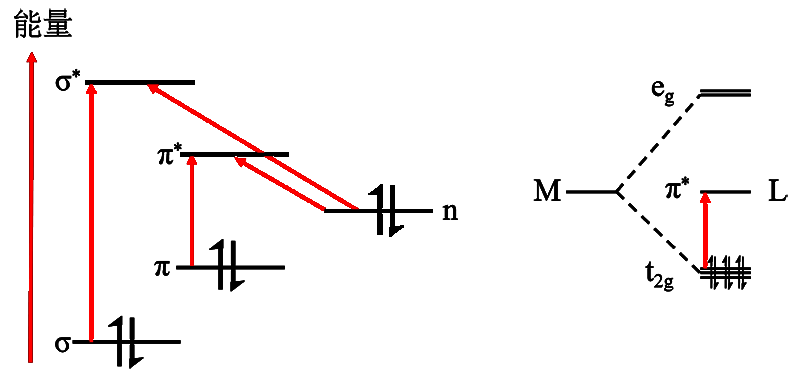
圖1 有機分子(左)及金屬有機絡合物分子(右)光吸收后電子激發(fā)過程示意圖
激發(fā)態(tài)分子生成規(guī)則
分子吸收光子發(fā)生電子激發(fā)過程中應遵循四個基本規(guī)則。
1. 自旋禁忌規(guī)則,成鍵或非鍵軌道上的電子對是一對自旋相反的電子,當電子發(fā)生躍遷時其自旋方向應保持不變;
2. 對稱禁阻原則,對于軌道有對稱中心的分子,只能發(fā)生對稱性翻轉(zhuǎn)的躍遷,如乙烯分子,其π軌道為對稱軌道,而π*軌道為反對稱軌道,所以可以發(fā)生π→π*躍遷;
3. 弗蘭克-康登原理(Frank-Condon principle),在電子躍遷后的瞬間,分子仍處于與躍遷前一樣的幾何狀態(tài);
4. 軌道重疊規(guī)則,電子躍遷涉及的兩個軌道在空間的同一個區(qū)域,即相互重疊時,才能發(fā)生躍遷,如σ軌道在沿著鍵的方向而π軌道在垂直于鍵的方向,不能發(fā)生σ→π*、π→σ*躍遷,只能發(fā)生σ→σ*、π→π*-躍遷。
由以上可知,有機分子吸收光子被激發(fā)到激發(fā)態(tài)后,電子對中一個電子激發(fā)到能量更高的軌道,變成兩個單電子,由于激發(fā)后電子自旋方向不變,兩個單電子的自旋方向依然相反。
根據(jù)洪特規(guī)則(Hund’s rules),兩個電子自旋相同時,排斥作用更小,能量更低,因而激發(fā)態(tài)分子有一定概率通過系間竄越損失部分能量變成兩個電子自旋方向相同的激發(fā)態(tài)分子。
激發(fā)態(tài)分子分類與反應形式
通常用多重態(tài)和能級來區(qū)分不同狀態(tài)下的激發(fā)態(tài)分子。
當把激發(fā)態(tài)分子放在強度適當?shù)拇艌鲋袝r,激發(fā)態(tài)的原子吸收和發(fā)射光譜中的譜線會發(fā)生裂分,通常用譜線裂分個數(shù)來定義多重態(tài)。電子自旋相反的激發(fā)態(tài)分子的譜線數(shù)為1,叫做單重態(tài)S;電子自旋相同的激發(fā)態(tài)分子的譜線數(shù)為3,叫做三重態(tài)T,大多數(shù)基態(tài)分子除氧氣外,其譜線數(shù)也為1,所以通常基態(tài)也簡寫為S。
根據(jù)能級來劃分,將基態(tài)定義為S0,距離S0能量最近的單重激發(fā)態(tài)叫做第一單重激發(fā)態(tài),簡寫為S1,其對應的三重激發(fā)態(tài)叫做第一三重激發(fā)態(tài),簡寫為T1,以此類推可以得到S2、S3、T2和T3等,如圖2所示n→π*躍遷后的激發(fā)態(tài)為S1,π→π*躍遷后的激發(fā)態(tài)為S2。
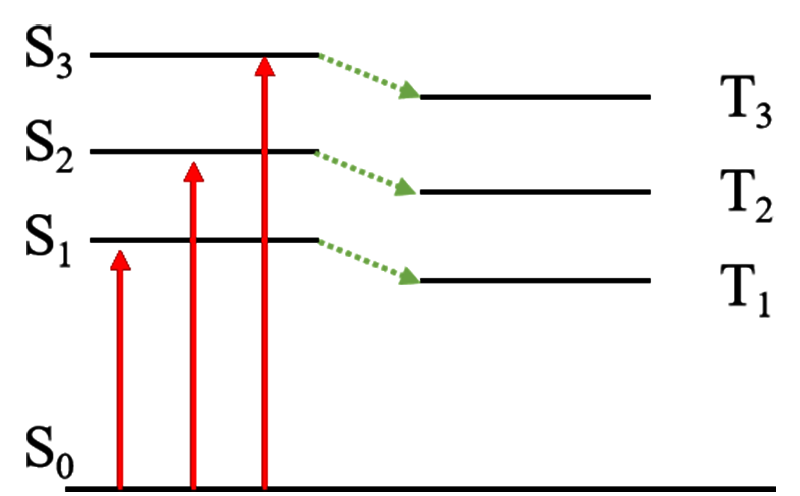
激發(fā)態(tài)分子壽命很短,通常只有10-9~10-3 s(單重態(tài)10-9~10-5 s,三重態(tài)10-5~10-3 s),生成以后它們會迅速通過物理過程或化學過程將所吸收的光能釋放。
物理過程主要有輻射過程(熒光和磷光)以及非輻射過程(內(nèi)部轉(zhuǎn)化、系間竄越和振動弛豫)等。
化學過程主要有以下幾種:
(1)單分子光化學反應是被激發(fā)的分子自身反應,主要有光分解、重排以及異構(gòu)化等反應;
(2)雙分子光化學反應是一個激發(fā)態(tài)分子與一個基態(tài)分子之間的反應,如環(huán)加成反應和聚合反應等;
(3)光催化反應是光敏劑或者光催化劑吸光變成激發(fā)態(tài),激發(fā)態(tài)光敏劑或者光催化劑通過氧化還原反應或者能量傳遞等方式引發(fā)其它化合物發(fā)生變化而自身回到基態(tài)的反應,包括光敏反應、光催化氧化還原反應等。
以上部分是筆者根據(jù)參考文獻進行翻譯和匯總,筆者水平有限,如有錯誤,請大家指正!
[1] M. H. Shaw, J. Twilton and D. W. C. Macmillan*, Photoredox Catalysis in Organic Chemistry[J], Journal of Organic Chemistry, 2016, 81(16), 6898.