在往期文章中,我們曾探討過Tafel斜率、過電位和光電流等電化學(xué)核心概念(→點擊查看合集),本期將聚焦電極極化,深度解析其原理與機制。
電極極化是指電極電位偏離其平衡電位的現(xiàn)象,通常由外加電流或電場引起。這一現(xiàn)象反映了電極反應(yīng)動力學(xué)和界面?zhèn)髻|(zhì)過程的綜合效應(yīng)。
在電極處于平衡狀態(tài)時,氧化反應(yīng)的速度等于還原反應(yīng)的速度,氧化反應(yīng)的電流 ia 與還原反應(yīng)的電流 ic 大小相等、方向相反,凈電流為零,此時電極電位保持在平衡電位。然而,當(dāng)施加一個擾動(如通電流)時,平衡被打破,氧化反應(yīng)速度與還原反應(yīng)速度不再相等,產(chǎn)生了凈電流,電極電位偏離了平衡電位,這種現(xiàn)象被稱為電極極化。
從理論上講,電極極化可以通過Nernst方程和電極動力學(xué)模型進行描述。根據(jù)Bard和Faulkner的研究,極化現(xiàn)象反映了電極反應(yīng)的動力學(xué)限制和界面?zhèn)髻|(zhì)過程的綜合效應(yīng)(Bard & Faulkner, 2001)。
電極極化的本質(zhì)在于電極反應(yīng)速率無法與電流通過時的電子傳遞速率相匹配。當(dāng)電流通過電極時,電極表面電荷的變化會引起雙電層的調(diào)整。只有當(dāng)界面反應(yīng)速率足夠快時,電子才能迅速被消耗,從而維持未通電時的平衡狀態(tài)。然而,在實際反應(yīng)中,電極反應(yīng)速率通常低于電子傳遞速率,導(dǎo)致電極表面電荷累積,雙電層區(qū)域的電場強度增大,電極電位偏離平衡值。隨著反應(yīng)速率的提高,電極與溶液界面趨于穩(wěn)定,雙電層結(jié)構(gòu)得以重新調(diào)整和恢復(fù)。
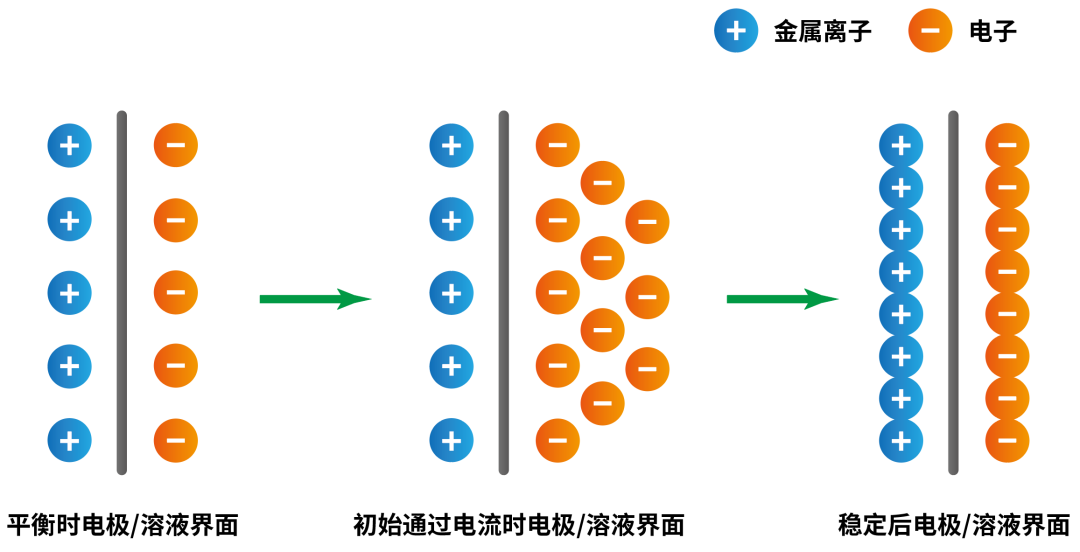
具體來說,當(dāng)電流通過電極時,電極/溶液界面會發(fā)生以下變化:
No.1 電子的積累與界面電位的偏移
在電極極化過程中,電子的流動導(dǎo)致電荷在電極表面累積,使電極電位偏離平衡狀態(tài)。這一現(xiàn)象可以通過Butler-Volmer方程進行描述:
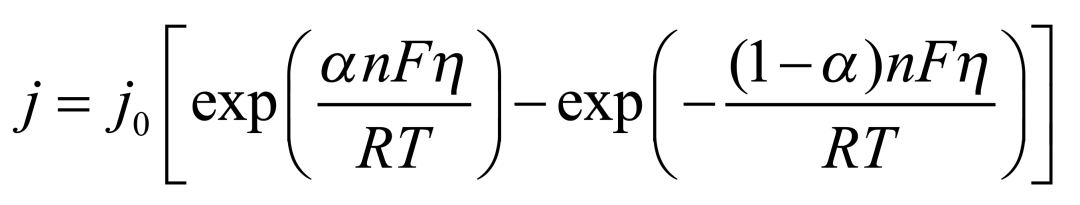
其中:
j 是電流密度,
j? 是交流電流密度,
η 是過電位(偏離平衡電位的電位差),
α 是電子位移系數(shù),
n 是電子數(shù),
F 是法拉第常數(shù),
R 是氣體常數(shù),
T 是絕對溫度。
由此可見,當(dāng)電極電位偏離平衡電位時,氧化還原反應(yīng)速率發(fā)生變化,導(dǎo)致極化現(xiàn)象的產(chǎn)生。
No.2 極化與去極化的動態(tài)平衡
在電極極化過程中,存在兩種對立的作用:
極化作用:電子的流動導(dǎo)致電荷在電極表面累積,使電極電位偏離平衡狀態(tài)。
去極化作用:電極反應(yīng)吸收電子,消耗累積的電荷,試圖恢復(fù)電極的平衡狀態(tài)。
由于電子的運動速度通常遠大于電極反應(yīng)速度,電極體系在通電時總是表現(xiàn)出極化現(xiàn)象。
No.3 陽極與陰極的極化現(xiàn)象
陰極極化:電子流入電極的速度大于反應(yīng)速度,負電荷在陰極表面積累,導(dǎo)致電極電位向負方向移動。
陽極極化:電子流出電極的速度大于反應(yīng)速度,正電荷在陽極表面積累,導(dǎo)致電極電位向正方向移動。
因此,電極極化現(xiàn)象的根本原因在于電子運動速度與電極反應(yīng)速度之間的矛盾。
根據(jù)極化現(xiàn)象的產(chǎn)生機制,電極極化可以分為以下兩類:
No.1 濃差極化
濃差極化是由于電極表面與溶液本體之間的反應(yīng)物或產(chǎn)物濃度差異引起的。其特點是:
? 電極反應(yīng)消耗或生成反應(yīng)物,使電極表面液層內(nèi)的離子濃度迅速降低或升高。
? 電極表面與溶液本體之間形成濃度梯度,導(dǎo)致電極電位偏離平衡值。
? 這種偏離值稱為濃差過電位。
濃差極化的本質(zhì)是傳質(zhì)過程的限制,即反應(yīng)物從溶液相向電極表面運動或產(chǎn)物從電極表面向溶液相運動的速度較慢。根據(jù)Fick擴散定律,濃差極化可以用以下公式描述:
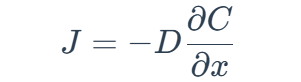
其中:
J 是擴散通量,
D 是擴散系數(shù),
C 是濃度,
x 是擴散距離。
No.2 電化學(xué)極化
電化學(xué)極化是由于電極反應(yīng)速度較慢,導(dǎo)致電荷在電極表面累積而引起的。其特點是:
? 當(dāng)電流密度較大時,電極反應(yīng)的電化學(xué)速度無法跟上電荷轉(zhuǎn)移的速度。
? 電極表面電荷的累積使電極電位偏離平衡值,產(chǎn)生電化學(xué)極化。
? 電化學(xué)極化與反應(yīng)活化能有關(guān),因此通常不可完全消除。