中國產(chǎn)業(yè)發(fā)展促進(jìn)會生物質(zhì)能產(chǎn)業(yè)分會發(fā)布的藍(lán)皮書指出,截至2020年,我國主要生物質(zhì)資源年產(chǎn)生量約為34.94億噸。生物質(zhì)作為地球上最豐富的可再生有機(jī)原料,具有綠色、低碳、清潔等優(yōu)點(diǎn),被認(rèn)為是未來能源和化學(xué)工業(yè)的重要發(fā)展方向。對于生物質(zhì)轉(zhuǎn)化,傳統(tǒng)的高溫氣化過程(通常> 700°C)消耗大量能源并導(dǎo)致額外的二氧化碳排放。光催化技術(shù)以其溫和的操作條件和高效的轉(zhuǎn)化效率,成為生物質(zhì)轉(zhuǎn)化領(lǐng)域的重要工具。本文旨在介紹光催化生物質(zhì)轉(zhuǎn)化的最新研究進(jìn)展,探討其應(yīng)用前景與挑戰(zhàn)。
半導(dǎo)體具有合適的帶隙,被廣泛用作光催化劑。一般來說,半導(dǎo)體捕獲光并被激發(fā)產(chǎn)生光生電荷,其中光生電子從的價(jià)帶(VB)躍遷到的導(dǎo)帶(CB),從而在VB和CB上分別留下正電荷和負(fù)電荷稱為光生空穴和光生電子。電荷將從本體轉(zhuǎn)移到表面并參與表面氧化還原反應(yīng)。對于光催化分解水產(chǎn)氫反應(yīng),從熱力學(xué)的角度考慮,光催化劑的CB最小值需要有比H?/H?能級更負(fù)的電位(-0.41 V vs. NHE),而VB最大值應(yīng)該具有比水的氧化電位更正的電位(0.82 V vs. NHE),相對于水分解1.23 V的熱力學(xué)勢壘,生物質(zhì)重整反應(yīng)由于有機(jī)分子的氧化還原電位較低,更容易發(fā)生。例如,葡萄糖的氧化電位僅為0.05 V vs. NHE,[1]生物質(zhì)相對較低的氧化還原電位使空穴淬滅更高效,增加了反應(yīng)的內(nèi)在驅(qū)動力,并促進(jìn)了光激發(fā)電子通過H?還原析氫。此外,通過生物質(zhì)光催化制氫可以利用窄帶隙半導(dǎo)體捕獲低能量光子,如可見光和紅外光,這些低能量光子在太陽光中占絕大多數(shù)。
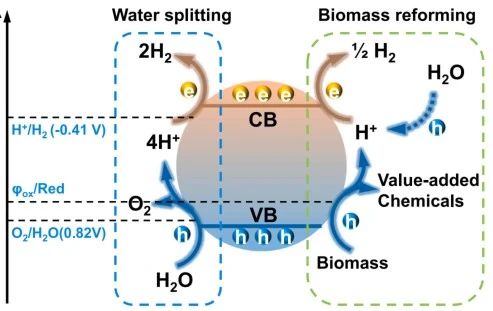
光催化水裂解和生物質(zhì)轉(zhuǎn)化制氫示意圖
然而,僅僅滿足熱力學(xué)要求并不能保證反應(yīng)的發(fā)生。吸附-半導(dǎo)體界面電子轉(zhuǎn)移對光反應(yīng)也有著十分重要影響。影響界面電子轉(zhuǎn)移的兩個(gè)主要因素是光載流子的俘獲狀態(tài)和有機(jī)分子的吸附,被捕獲的電荷應(yīng)轉(zhuǎn)移到半導(dǎo)體表面才能順利發(fā)生光反應(yīng)。[2]對于質(zhì)子型生物質(zhì)原料,如醇和酸,質(zhì)子耦合電子轉(zhuǎn)移(PCET)過程在界面電荷轉(zhuǎn)移中起著至關(guān)重要的作用。與單個(gè)質(zhì)子轉(zhuǎn)移/電子轉(zhuǎn)移過程相比,PCET過程中質(zhì)子和電子同時(shí)轉(zhuǎn)移的能量勢壘較低。
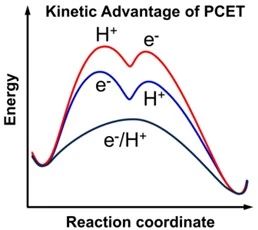
PCET過程的動力學(xué)優(yōu)勢示意圖
另一個(gè)因素是分子在表面的吸附狀態(tài),受催化劑表面性質(zhì)、分子結(jié)構(gòu)和溶劑條件的影響。例如,在水與乙酸分子相互作用下,乙酸在(101)表面的配位模式將由橋接雙齒變?yōu)閱锡X,吸附能降低1.17 eV,[3]因此,調(diào)整吸附構(gòu)型可以有效地促進(jìn)界面電荷轉(zhuǎn)移,提高光催化活性。
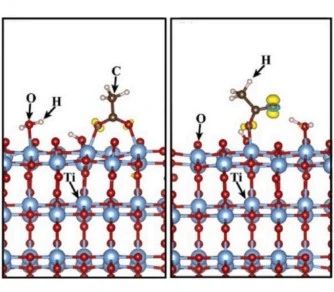
水煤氣(CO和H?)是當(dāng)今化學(xué)工業(yè)的主要組成部分之一,在烯烴或芳烴的合成或通過費(fèi)托合成法合成液體燃料等方面有著重要的應(yīng)用。傳統(tǒng)生物質(zhì)轉(zhuǎn)化水煤氣是通過高溫氣化產(chǎn)生的,不僅消耗大量的能源,還會釋放大量的CO?。[4]
生物質(zhì)生產(chǎn)CO會破壞C-C鍵主鏈,光催化重整有望在溫和條件下實(shí)現(xiàn)C-C鍵的裂解。然而,光催化法面臨的挑戰(zhàn)在于選擇性的破壞C-C主鏈并避免過度氧化生成CO?。以甘油為例,從熱力學(xué)角度來看,CO?的生成比CO的生成更有利,反應(yīng)能量更小。
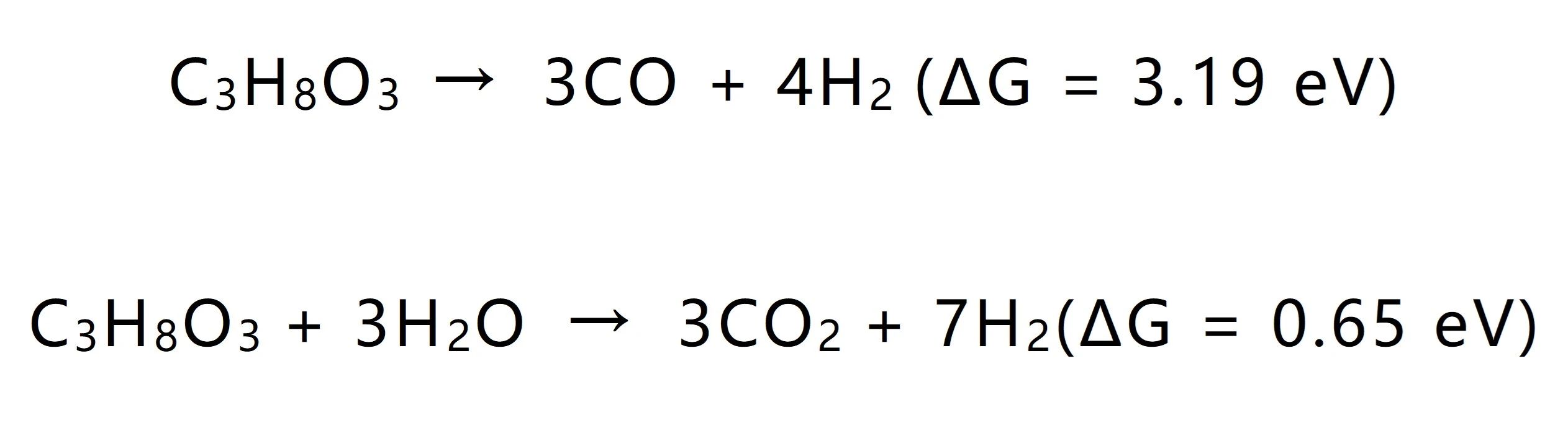
C-C鍵的裂解方式會影響CO和CO?的生成比例,醛類中間體脫羰反應(yīng)會生成CO,脫羧反應(yīng)會生成CO?,因此,要想選擇性的獲得CO,要避免醛基向羧基的過度氧化。羥基自由基(·OH)是醛過度氧化生成羧基的主要原因。當(dāng)使用帶隙較寬的半導(dǎo)體(如3.2 eV的TiO?)時(shí),光激發(fā)空穴可以氧化水生成·OH, ·OH具有較強(qiáng)的過氧化能力。例如,TiO?的空穴氧化電位約為2.9 V vs. NHE,足以將水氧化為·OH (2.27 V vs. NHE)。[5]
2020年,Wang等人采用了一種水-乙腈溶劑體系來阻止生物多元醇在Cu/TiO?上光催化過程中過度氧化為CO?,通過降低水的濃度,顯著地阻止了水氧化為·OH,從而減緩了CO?的生成。[6]然而,在光催化過程中,水是溶解多元醇和糖的必要助溶劑。生物多元醇和水將競爭性地吸附在半導(dǎo)體表面。通過調(diào)控催化劑表面形貌、缺陷等手段,促進(jìn)生物質(zhì)分子在半導(dǎo)體上的吸附也是提高CO選擇性的有效途徑。
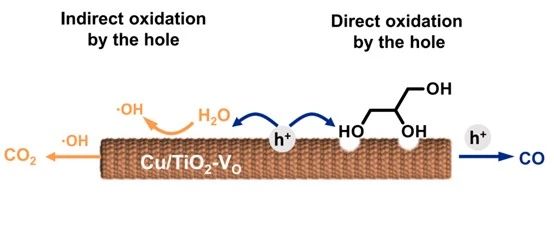
甘油空穴氧化反應(yīng)機(jī)制
影響CO選擇性的另一個(gè)因素是甲酸(FA)中間體的分解。FA的脫羰(脫水)反應(yīng)生成CO,脫羧(脫氫)反應(yīng)生成CO?。因此,促進(jìn)FA脫水理論上可以提高CO的選擇性。但脫氫反應(yīng)(-48.8 kJ·mol?¹)比脫水反應(yīng)(-28.5 kJ·mol?¹)在熱力學(xué)方面更具優(yōu)勢,甲酸中間體脫水更難進(jìn)行。[7]實(shí)驗(yàn)表明,TiO?對FA脫水具有選擇性,而目前報(bào)道的TiO?基光催化劑仍然傾向于遵循FA的脫氫。[8]這可能是由于TiO?基催化劑中的其他成分如金屬和金屬氧化物促進(jìn)了脫氫反應(yīng)。在Cu/TiO?的情況下,CO/ CO?產(chǎn)量比受銅負(fù)載量的影響很大。高銅負(fù)載導(dǎo)致CuO?納米顆粒占主導(dǎo)地位,有利于脫氫反應(yīng)產(chǎn)生CO?。在低銅負(fù)載下,摻雜Cu²?占主導(dǎo)地位,F(xiàn)A脫水發(fā)生在TiO?相上,生成CO。因此,降低銅的含量可以提高CO的選擇性。
使用窄帶半導(dǎo)體是獲得高CO選擇性的另一種選擇。與只在紫外光下有活性的帶隙較大的金屬氧化物不同,金屬硫化物具有較窄的帶隙和溫和的氧化能力。輕度氧化能力的金屬硫化物可能無法氧化水中產(chǎn)生·OH,因此可以阻止生物多元醇過度氧化為CO?。在可見光照射下,CdS對多元醇轉(zhuǎn)化為CO具有一定活性,不產(chǎn)生CO?,但效率較低。
與化石燃料不同,生物質(zhì)含有更高的氧含量和各種含氧官能團(tuán)。這種特性可以使生物質(zhì)轉(zhuǎn)化與析氫反應(yīng)相結(jié)合,促進(jìn)了高附加值化學(xué)品和H?的同時(shí)生產(chǎn)。例如,木質(zhì)纖維素衍生的多羥基分子,如糖或多元醇,光催化生成乳酸和H?。為了避免生物質(zhì)的過度氧化,光催化劑應(yīng)具有適度的VB位置,如過渡金屬硫化物,磷化物、CuO和g-C?N?, 由于其合適的能帶位置而被廣泛應(yīng)用于這些體系中。通常引入貴金屬作為析氫位點(diǎn)來促進(jìn)反應(yīng)。[9]
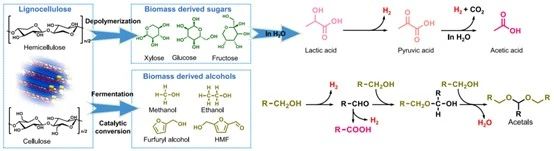
光催化木質(zhì)纖維素衍生化學(xué)品轉(zhuǎn)化和制氫路線
5-羥甲基糠醛(HMF)是一種重要的生物質(zhì)衍生物,可以進(jìn)一步氧化并同時(shí)生成H?。在HMF選擇性氧化制取高值化學(xué)品和H?的過程中,光催化劑的選擇起著至關(guān)重要的作用。過渡金屬硫化物或g-C?N?被廣泛用于此。在中性水中,通過Ni/ CdS光催化HMF脫氫產(chǎn)生2,5-二甲酰呋喃(DFF)和H?。該反應(yīng)在堿性溶液中可顯著加速,但會被過度氧化為2,5-呋喃二羧酸(FDCA)。調(diào)節(jié)光生空穴的氧化能力是防止DFF過氧化的有效方法。[9]
其他生物質(zhì)衍生醇,如甲醇、乙醇、苯甲醇和呋喃醇也可以脫氫成醛和H?,當(dāng)反應(yīng)在純醇中進(jìn)行時(shí),所產(chǎn)生的醛可以進(jìn)行縮醛化過程,將兩個(gè)醇分子結(jié)合并在酸性催化劑上或在非均相催化劑的酸性位點(diǎn)上形成縮醛。例如,以乙醇為例,生成的乙醛的C=O基團(tuán)可以被另一個(gè)乙醇分子的O原子進(jìn)一步攻擊,破壞C=O的π鍵,形成半縮醛。然后,這種半縮醛與另一種乙醇分子脫水,在酸性催化劑上形成1,1-二氧乙烷(1,1- DEE)。[10]
傳統(tǒng)高能量密度的碳基燃料主要由長碳鏈組成,碳?xì)浠衔锿ǔ:?0個(gè)以上的碳原子。然而,大多數(shù)生物質(zhì)資源含有少于10個(gè)碳原子的基本單元。例如,木質(zhì)纖維素是最豐富的生物質(zhì)資源,包括纖維素、半纖維素和木質(zhì)素。葡萄糖和木糖是纖維素和半纖維素的基本單位,分別含有6個(gè)和5個(gè)碳原子。木質(zhì)素來源于三個(gè)基本單位:對香豆醇、松柏醇和新樹醇。木質(zhì)素解聚通常產(chǎn)生C7-C9單體為了利用生物質(zhì)生產(chǎn)高能液體燃料,必須通過C-C鍵偶聯(lián)來增加碳鏈長度。[11]光催化法可以通過碳-氫鍵的homo裂解實(shí)現(xiàn)碳中心自由基碳-碳鍵偶聯(lián)。在這個(gè)過程中,C-H鍵的電子被轉(zhuǎn)移去猝滅光激發(fā)的空穴,產(chǎn)生碳中心自由基并釋放質(zhì)子。碳中心自由基的偶聯(lián)使碳鏈加倍,而質(zhì)子被光生電子還原生成H?。這個(gè)過程被稱為光催化脫氫偶聯(lián),被有效地用于H?和柴油或噴氣燃料前體的耦合生產(chǎn)。在木質(zhì)纖維素衍生的下游產(chǎn)品中,2,5-DMF和2-甲基呋喃(2-MF)是與柴油燃料耦合制氫的有希望的原料。這兩種化合物分別可以通過HMF和糠醛的脫氧得到。
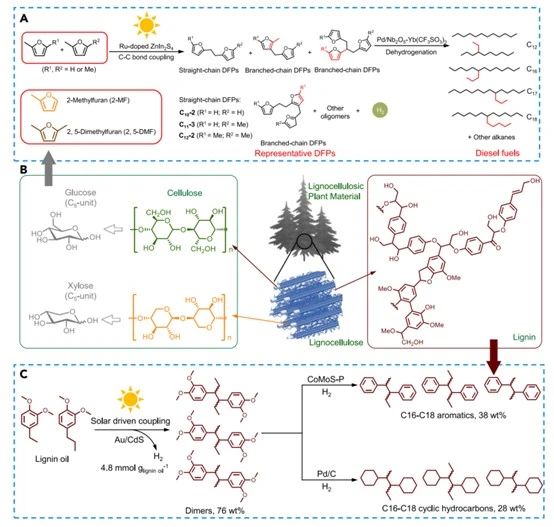
圖A.光催化制氫與甲呋喃生產(chǎn)生物柴油前驅(qū)體耦合;圖B.木質(zhì)纖維素復(fù)合材料;圖C.木質(zhì)素油光催化制氫耦合生物柴油前驅(qū)體
除了聯(lián)合生產(chǎn)燃料前體外, C-C鍵偶聯(lián)也可用于合成增值化學(xué)品。簡單的單醇,如甲醇、乙醇和丁醇,可以通過化學(xué)或生物方法從生物質(zhì)中提取。這些簡單的單醇可以作為原料用于生產(chǎn)氫,并形成二醇。二醇被廣泛用作聚酯的單體。例如,乙二醇(EG)是合成聚乙二醇對苯二甲酸乙二醇酯的單體,是我們?nèi)粘I钪惺褂米顝V泛的樹脂。
光催化技術(shù)展現(xiàn)了在溫和條件下從生物質(zhì)中提取氫氣及生產(chǎn)增值化學(xué)品的巨大潛力。盡管已有諸多新反應(yīng)與催化劑問世,但其效率尚不足以支撐實(shí)際應(yīng)用,需設(shè)計(jì)高性能光催化劑以提升效率。傳統(tǒng)方法如改善光吸收與電荷分離依舊有效,但生物質(zhì)分子的復(fù)雜性對目標(biāo)產(chǎn)品的選擇性生產(chǎn)構(gòu)成挑戰(zhàn)。調(diào)控光催化劑結(jié)構(gòu),如引入空間效應(yīng)、孔徑效應(yīng)等,有望提升選擇性。同時(shí),控制氧化深度以防生物質(zhì)深度降解為CO?至關(guān)重要。金屬硫化物因具備更好的陽光響應(yīng)與溫和氧化能力而受青睞,但需精細(xì)調(diào)整其價(jià)帶氧化電位以平衡反應(yīng)速率與選擇性。此外,開發(fā)高效光反應(yīng)器、促進(jìn)電子/質(zhì)子轉(zhuǎn)移及構(gòu)建半人工光合系統(tǒng),均為提高光催化效率的關(guān)鍵路徑。盡管光催化技術(shù)具備顯著優(yōu)勢,但實(shí)現(xiàn)工業(yè)規(guī)模應(yīng)用仍需克服溶解度差、產(chǎn)物選擇性低及光反應(yīng)器技術(shù)滯后等挑戰(zhàn)。未來研究應(yīng)聚焦于優(yōu)化催化劑設(shè)計(jì)、開發(fā)高效反應(yīng)器及探索經(jīng)濟(jì)可行的生產(chǎn)工藝。
Wang, M., Zhou, H.J., Wang, F. (2024). Photocatalytic biomass conversion for hydrogen and renewable carbon-based chemicals. Joule. 3, 604-621.
[1] Vogt, S., Schneider, M., Sch?fer-Eberwein, H., and N?ll, G. (2014). Determination of the pH dependent redox potential of glucose oxidase by spectroelectrochemistry. Anal. Chem. 86, 7530–7535.
[2]Huang,W.,Su,C.,Zhu,C.,Bo,T.,Zuo,S.,Zhou, W., Ren, Y., Zhang, Y., Zhang, J., Rueping, M., et al. (2023). Isolated electron trap-induced charge accumulation for efficient photocatalytic hydrogen production. Angew. Chem. Int. Ed. Engl. 62, e202304634.
[3] Zhang, H., Zhou, P., Ji, H., Ma, W., Chen, C., and Zhao, J. (2018). Enhancement of photocatalytic decarboxylation on TiO? by water-induced change in adsorption-mode. Appl. Catal. B 224, 376–382.
[4] Huber, G.W., Iborra, S., and Corma, A. (2006). Synthesis of transportation fuels from biomass: chemistry, catalysts, and engineering. Chem. Rev. 106, 4044–4098.
[5] Wang, H., Jiang, S., Shao, W., Zhang, X., Chen, S., Sun, X., Zhang,Q., Luo, Y.,andXie,Y. (2018). Optically switchable photocatalysis in ultrathin black phosphorus nanosheets. J. Am. Chem. Soc. 140, 3474–3480.
[6] Wang, M., Liu, M., Lu, J., and Wang, F. (2020). Photo splitting of bio-polyols and sugars to methanol and syngas. Nat. Commun. 11, 1083.
[7] Kuehnel, M.F., Wakerley, D.W., Orchard, K.L., and Reisner, E. (2015). Photocatalytic formic acid conversion on CdS nanocrystals with controllable selectivity for H? or CO. Angew. Chem. Int. Ed. Engl. 54, 9627–9631.
[8] Henderson, M.A. (1997). Complexity in the decomposition of formic acid on the TiO?(110) surface. J. Phys. Chem. B 101, 221–229.
[9] Kang, F., Shi, C., Zhu, Y., Eqi, M., Shi, J., Teng, M., Huang,Z., Si, C.,Jiang, F., and Hu, J. (2023). Dual-functional marigold-like ZnxCd1-xS homojunction for selective glucose photoreforming with remarkable H? coproduction. J. Energy Chem. 79, 158–167.
[10] Lai, Y., Zeng, Y., Chen, X., Wang, T., Yang, X., and Guo, Q. (2023). Photochemistry of ethanol on rutile TiO2(110): breaking two bonds with one hole. J. Phys. Chem. C 127, 1863–1869.
[11] Mika,L.T., Cséfalvay, E., and Németh, Á. (2018). Catalytic conversion of carbohydrates to initial platform chemicals: chemistry and sustainability. Chem. Rev. 118, 505–613.